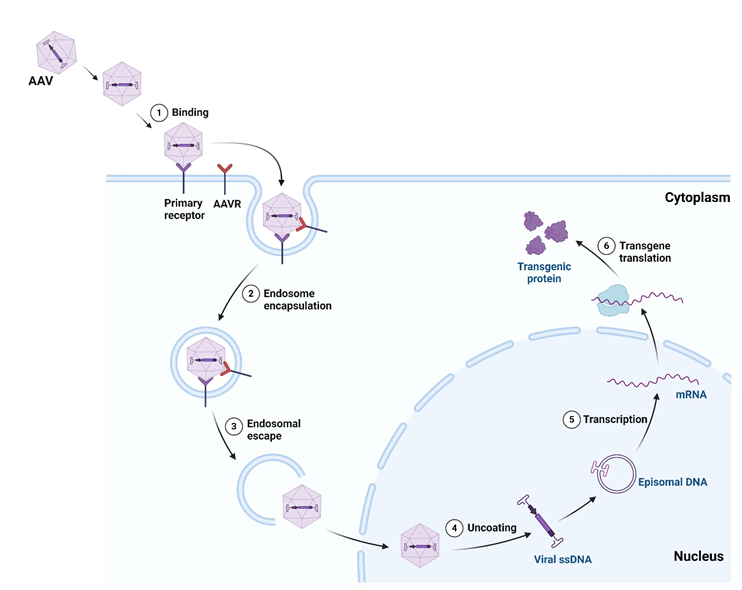
图1 AAV入侵细胞示意图
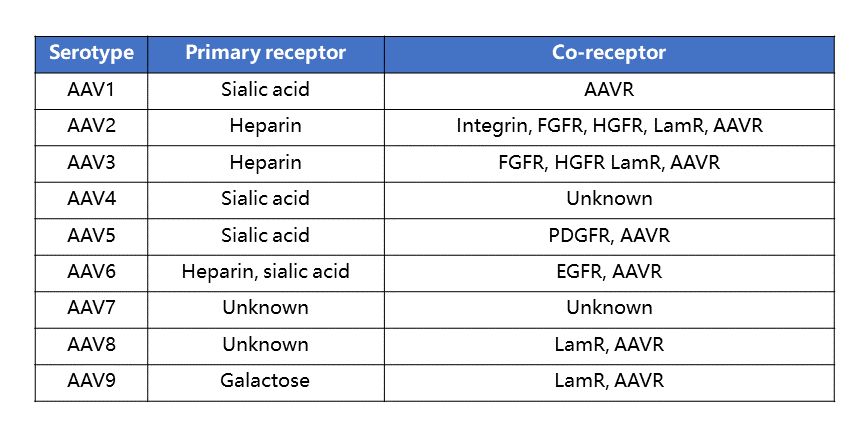
表1 不同AAV血清型的细胞表面受体不同1
-
细胞/组织特异性; -
注射方式和AAV的产量。静脉注射的给药剂量较高,因此需要选择产量更高的血清型,如AAV9、AAV8、AAVrh.10等,而原位注射的给药剂量较低,因此即使AAV的产量较低也可以满足实验需求; -
AAV血清型的流行病学特征。不同地区的物种可能感染过不同血清型的AAV,因此体内可能存在不同AAV的中和抗体。中和抗体会影响AAV的靶向递送效率; -
物种差异。同一种血清型对不同物种的感染效率会有差异,如在小动物中,AAV9对心肌细胞的感染效率优于AAV6,而在羊、猪、猴等大动物中,AAV6对心脏的感染效率要高于AAV9。(图2,图3,图4,图5,表2)
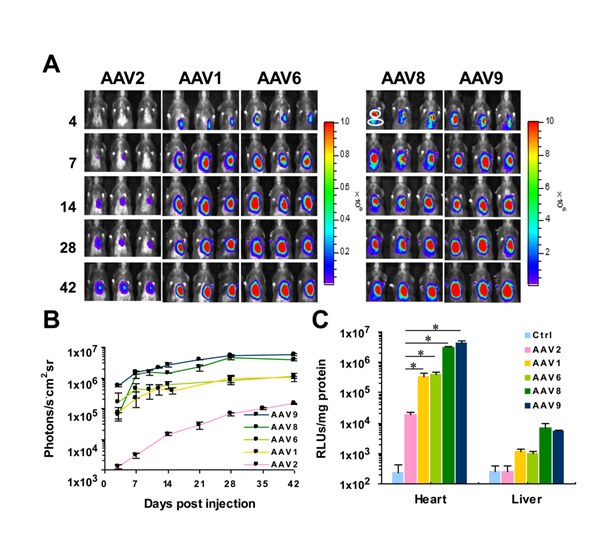
图2五种AAV血清型在小鼠体内的心脏基因递送效率比较2。注射方式为左心室前壁注射,病毒注射总量为5×10^10 vg,体积为10μl。Luc的表达由cTnT启动子控制。
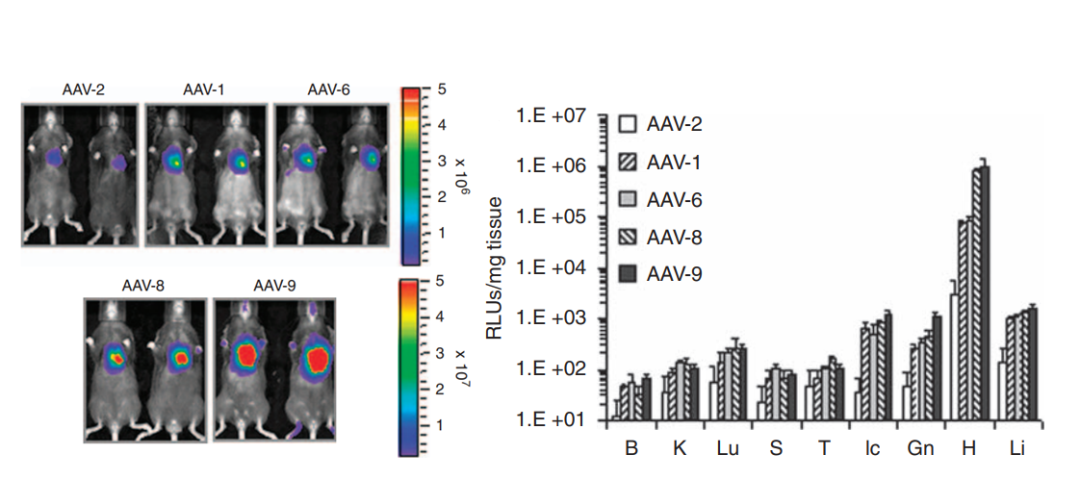
图3 五种AAV血清型在小鼠体内的心脏基因递送效率比较3。注射方式为颈静脉注射,病毒注射总量为1×10^11 vg/小鼠。Luc的表达由cTnT启动子控制。
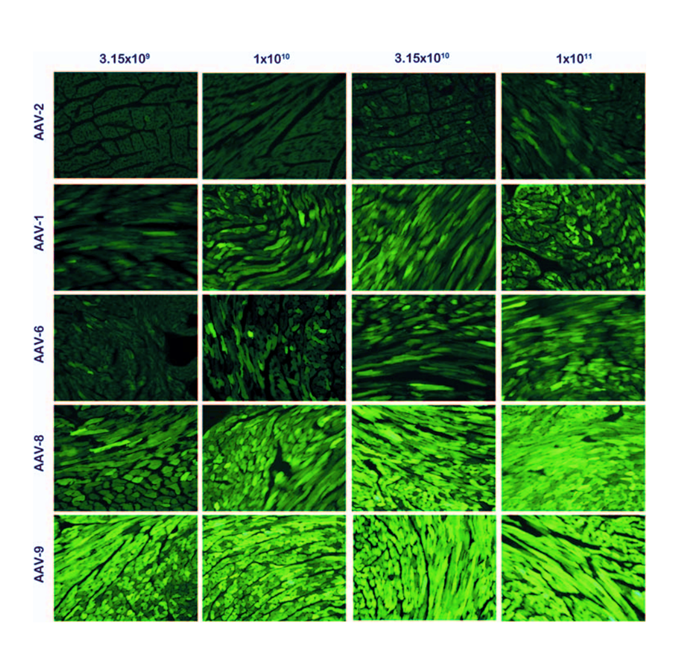
图4 五种AAV血清型以不同剂量注射至小鼠体内的心脏基因递送效率比较3。注射方式为颈静脉注射。EGFP的表达由cTnT启动子控制。
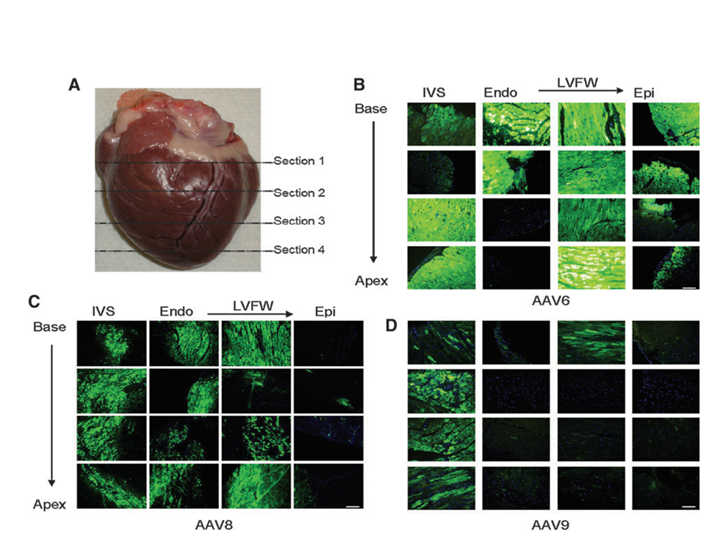
图5 三种AAV血清型在猕猴体内的心脏基因递送效率比较4。注射方式为心内膜注射,病毒注射量为5.4×10^12 vg/kg。EGFP的表达由CBG启动子控制。Endo,心内膜;Epi,心外膜;IVS,室间隔;LVFW,左心室游离壁。比例尺=200微米。
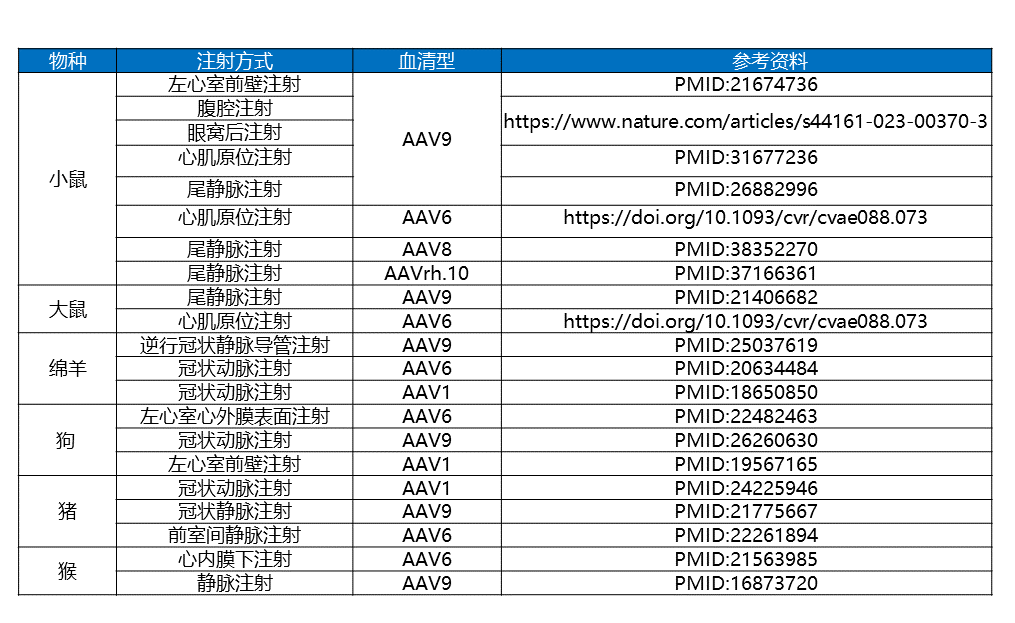
表2 不同物种、注射方式的AAV血清型应用举例
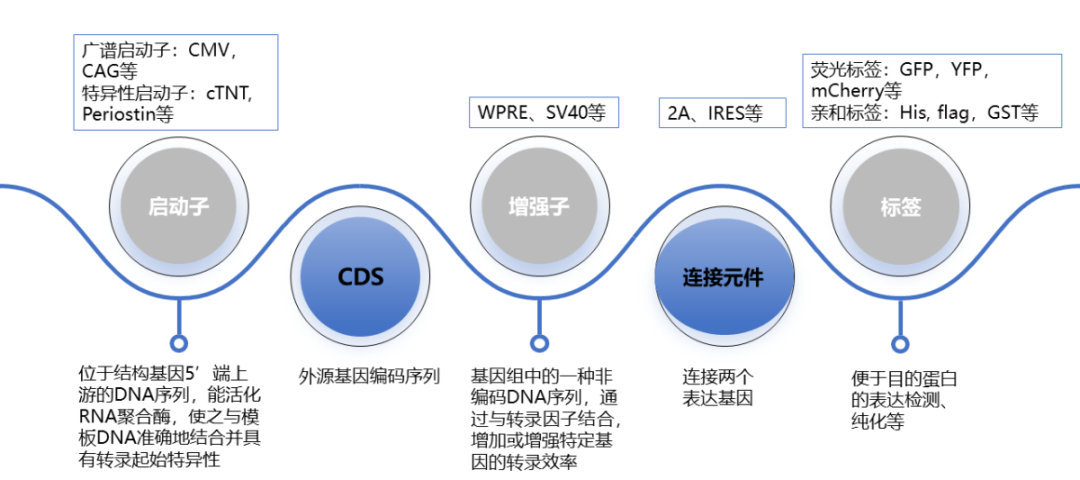
图6 基因递送载体的各种要素
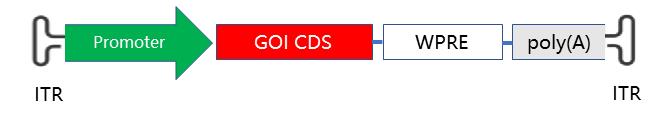
图7 AAV GOI质粒的常用结构示意图
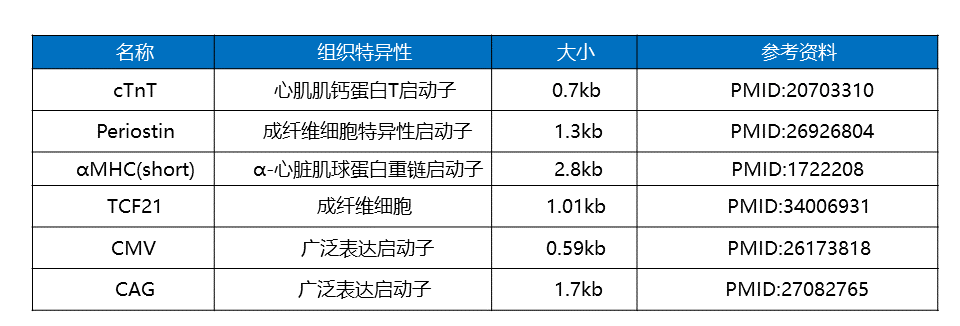
表3 心脏研究中常用的启动子
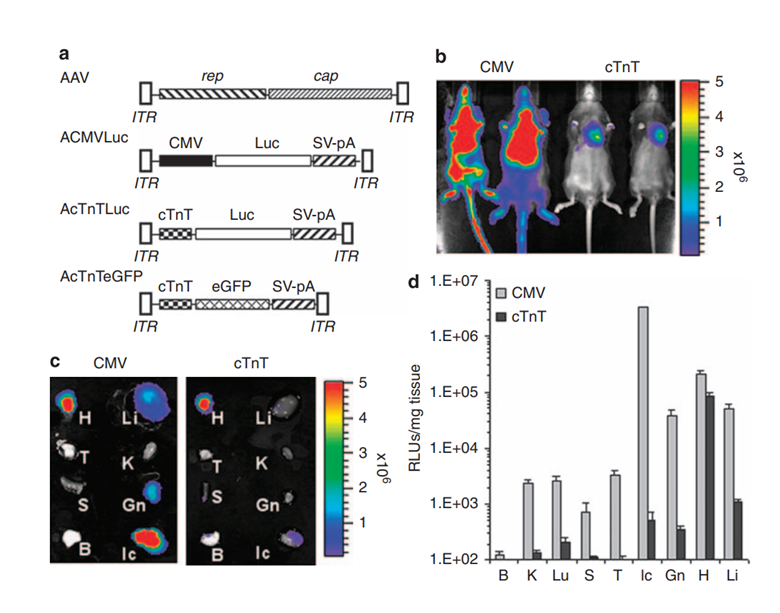
图8 cTnT启动子驱动的心肌细胞特异性基因表达3。AcMVLuc(CMV)和AcTnTLuc(cTnT)被包装进AAV6衣壳。通过颈静脉注射至一周龄的小鼠,剂量为1×10^11 vg/只。给药后的第28天检测荧光素酶活性。H,心脏;L,肝脏;T,胸腺;K,肾脏;S,脾脏;Gn,腓肠肌;B,大脑;Ic,肋间肌。
-
内含子。真核mRNA内含子在真核生物基因表达调控中起着重要的作用,是转基因研究中提高外源基因表达的重要元件之一。在多数情况下,真核mRNA内含子的存在可以提高基因的表达水平,因为其剪接过程会影响mRNA新陈代谢的多个阶段,包括转录、RNA编辑、pre-mRNA的加工、mRNA的出核运输、翻译等。在载体容量允许的情况下添加一个内含子,有助于刺激基因的表达。已上市的眼科基因治疗药物Luxturna就添加了一个内含子,以刺激功能性RPE65基因的表达(图9)。
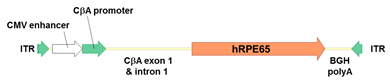
图9 Luxturna药物结构示意图5
-
MicroRNA结合位点。MicroRNA(微小RNA,简称miRNA)是一类不超过22个核苷酸的小分子RNA,它们在基因表达调控中扮演着关键角色。尽管microRNA本身并不编码蛋白质,但它们通过与特定的信使RNA(mRNA)结合,精确地调控了基因表达的过程。在细胞内,microRNA会与特定的mRNA分子互补结合,通常是在mRNA的3’非编码区,这种结合会导致mRNA的降解或者翻译抑制,从而减少相应蛋白质的合成。北京大学基础医学院郭宇轩研究员团队通过在AAV9-Tnnt2转基因的3’UTR引入miR122的靶序列,大幅降低了AAV9-Tnnt2在肝脏组织中的表达泄露,提高了其心脏表达的特异性6。
目前常见的AAV导入心脏的方式有心肌注射、冠状动脉注射和静脉注射等,其中静脉注射包括尾静脉注射、颈静脉注射和面部静脉注射等。各种导入方式的优缺点如下表(表4)
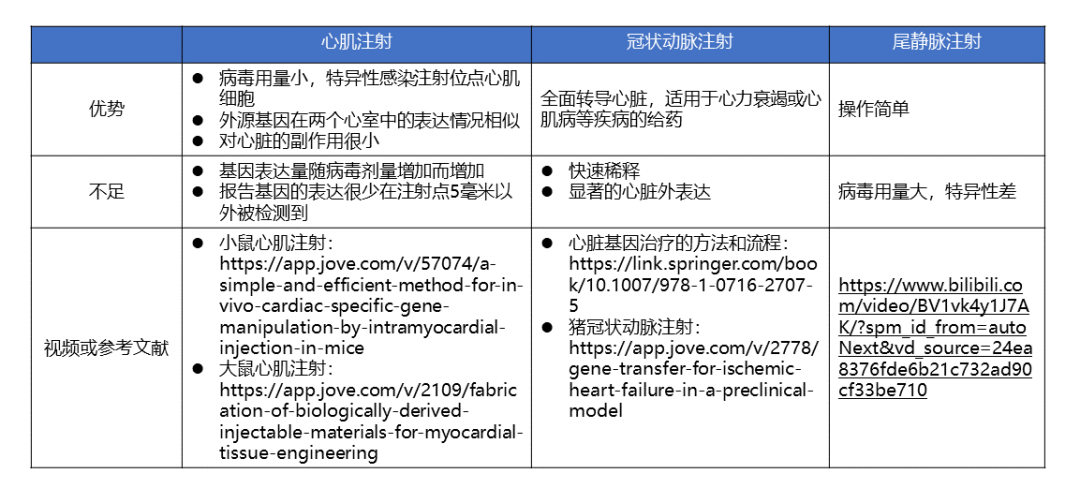
表4 AAV导入心脏的方式比较
视频参考链接如下:
1.小鼠心肌注射:https://app.jove.com/v/57074/a-simple-and-efficient-method-for-in-vivo-cardiac-specific-gene-manipulation-by-intramyocardial-injection-in-mice
2.大鼠心肌注射:https://app.jove.com/v/2109/fabrication-of-biologically-derived-injectable-materials-for-myocardial-tissue-engineering
3.心脏基因治疗的方法和流程:https://link.springer.com/book/10.1007/978-1-0716-2707-5
4.猪冠状动脉注射:https://app.jove.com/v/2778/gene-transfer-for-ischemic-heart-failure-in-a-preclinical-model
文献参考链接如下:
https://www.bilibili.com/video/BV1vk4y1J7AK/?spm_id_from=autoNext&vd_source=24ea8376fde6b21c732ad90cf33be710
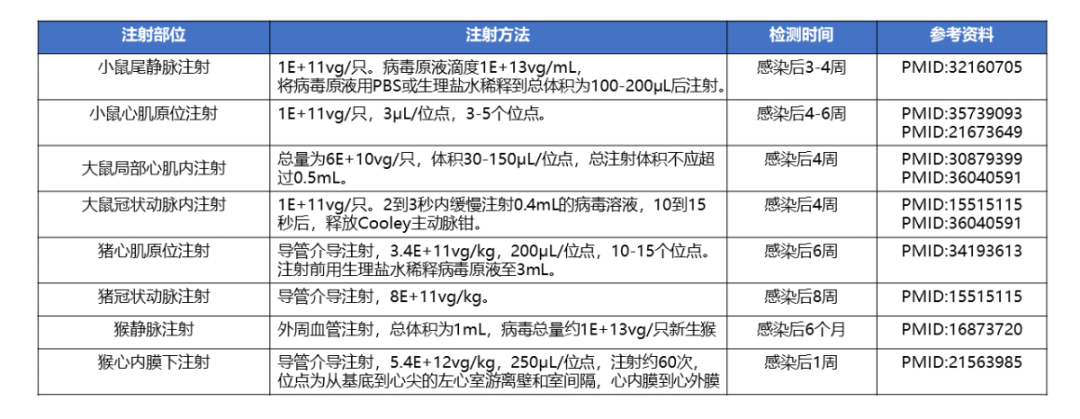
表5 不同物种的AAV注射方式和检测时间举例
