
研究团队将SB11或SB100X转座酶编码序列包装到AAV8载体中,通过腹腔注射将这些载体导入到新生C57Bl/6小鼠体内。组织学分析表明,SB100X和PB系统在稳定基因修饰细胞的比例上显著优于SB11,尤其是在SB100X组中,稳定转基因细胞比例比无转座酶组高出6倍。
进一步的实验表明,rAAV/SB系统介导的转基因表达在成年后依然稳定,特别是在使用SB100X时,基因表达水平显著增强且稳定。相比之下,SB11组表现较弱。SB100X与PB系统在基因表达水平和稳定性上表现出相似的效果。
为了验证该系统的临床应用潜力,研究团队用表达人凝血因子IX(FIX)的SB转座子载体,对新生小鼠进行了治疗。结果显示,使用SB100X的FIX活性显著高于SB11组,且FIX蛋白水平在血浆中大幅提升,表明rAAV/SB混合系统在快速增殖的肝脏细胞中可以实现高效的治疗性基因表达。
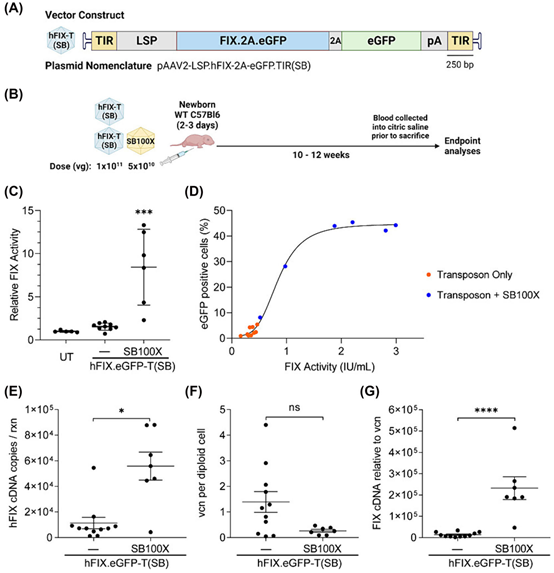
图1 rAAV/SB系统向新生小鼠递送人凝血因子IX (hFIX) 的治疗效果
在OTC缺陷的小鼠模型中,rAAV/SB100X系统显著延长了小鼠的生存期,并降低了尿液中的鸟氨酸水平。相比于单独使用OTC表达载体,rAAV/SB系统在增加OTC阳性细胞比例和OTC mRNA表达水平方面具有显著优势,进一步验证了其在治疗遗传性肝病中的潜力。
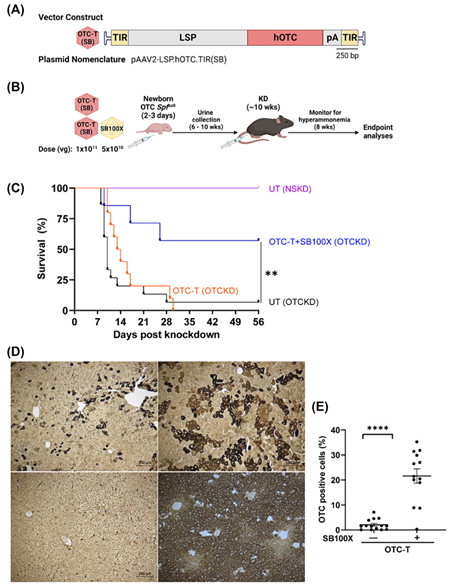
图2 OTC缺陷Spfash小鼠的表型矫正。
总之,这项研究首次展示了rAAV+Sleeping Beauty转座子系统在新生小鼠肝脏中的有效性和长期稳定性,特别是在治疗新生儿发病的遗传性肝病中有良好的应用前景。尽管PB系统在某些方面表现更佳,但SB系统在基因整合的随机性和潜在的安全性方面具有一定的优势。未来的研究可进一步探索SB系统在临床应用中的潜力,特别是通过短暂表达转座酶来优化治疗效果。
