自CRISPR-Cas9发现以来,科学家们希望在自然界中发现不同的CRISPR-Cas系统,通常会挖掘基因组序列数据库以寻找同源性,也就是具有高度相似氨基酸序列的蛋白质。基于这种方法已经促成了具有新特性(体积更小、更以递送)的新型基因组编辑工具的发现。此后,科学不仅发现了CRISPR蛋白之间的同源性,还发现了其他蛋白质之间的同源性(例如Cas9和Cas12与转座子的相似性)。
以Cas13为代表的VI型CRISPR-Cas系统,与Cas9和Cas12不同,Cas13是通过靶向入侵的可移动遗传元件的RNA转录物,为原核生物提供适应性免疫。Cas13介导的RNA靶向作用是通过Cas13蛋白及其 crRNA的作用实现的,它们共同作为一种RNA引导的核糖核酸酶发挥作用。
所有的Cas13都拥有两个高等真核生物和原核生物核苷酸结合(HEPN)结构域;之前的研究已经表明,这些结构域会在分子内二聚化,以响应靶标转录本的识别而形成活性位点。
HEPN结构域并非Cas13所独有,其以高度多样性和序列保守性差而闻名,这阻碍了标准的同源性检索,并使进化分析具有挑战性。因此,与其他广泛研究的Cas核酸内切酶(例如Cas9和Cas12)相比,迄今为止已确定的不同Cas13的的亚型很少,并且我们对它们的进化起源仍然知之甚少。
2024年7月18日,2020年诺贝尔化学奖得主、CRISPR基因编辑技术奠基人之一的 Jennifer Doudna 教授在国际顶尖学术期刊 Science 上发表了题为:Structure-guided discovery of ancestral CRISPR-Cas13 ribonucleases 的研究论文。
该研究将基于AlphaFold2的人工智能的蛋白质结构预测与传统结构比对程序结合,开发出了一种自动化结构检索,发现了Cas13的祖先——Cas13an,并进一步解析了Cas13an的结构及其作用机制,还将Cas13的起源追溯到与防御相关的核糖核酸酶(ribonuclease)。

近年来,在AlphaFold2等人工智能工具的帮助下,结构数据库迅速发展。这给了研究团队以希望——不管氨基酸序列如何,只要寻找相似的结构,就能找到其他Cas13.
在这项研究中,研究团队构建了一个自动化结构检索管线,该管线将基于人工智能的检索方法的速度与传统结构比对程序的灵敏度相结合。利用这个管线,研究团队确定了一个Cas13的祖先分支——Cas13an,并将 Cas13的起源追溯到与防御相关的核糖核酸酶。
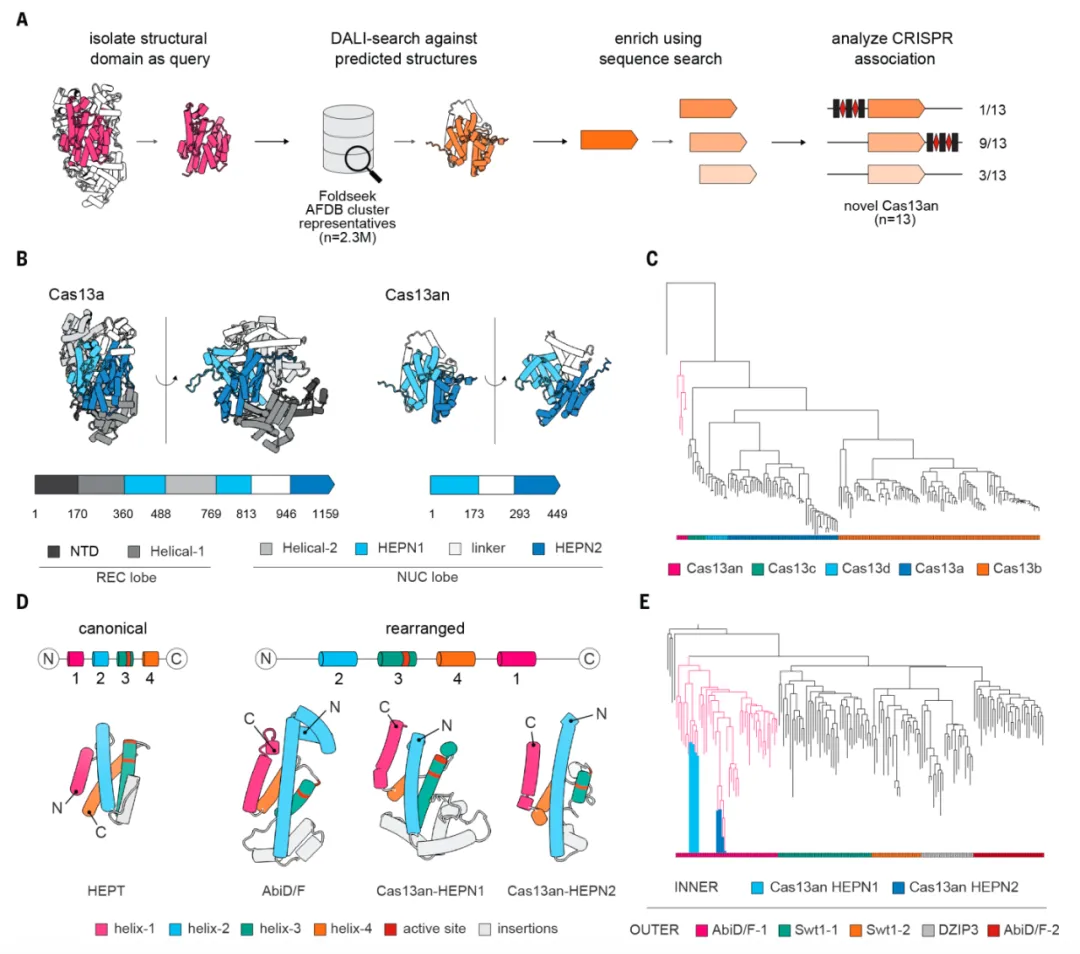
该研究还发现,与其他Cas13相比,Cas13an的尺寸较小,仅449个氨基酸,是其他Cas13的三分之一(例如Cas13a是1159个氨基酸),但当它与靶向绿色荧光蛋白(GFP)的crRNA在大肠杆菌中共表达时,能够有选择性地靶向GFP的mRNA,并HEPN结构域对于此活性至关重要。 当Cas13an与选定的靶向噬菌体的crRNA在大肠杆菌中共表达时,它还能为多种噬菌体提供防御。Cas13an这种小型化的Cas13仍然功能齐全,为研究人员扩展了RNA编辑工具箱。
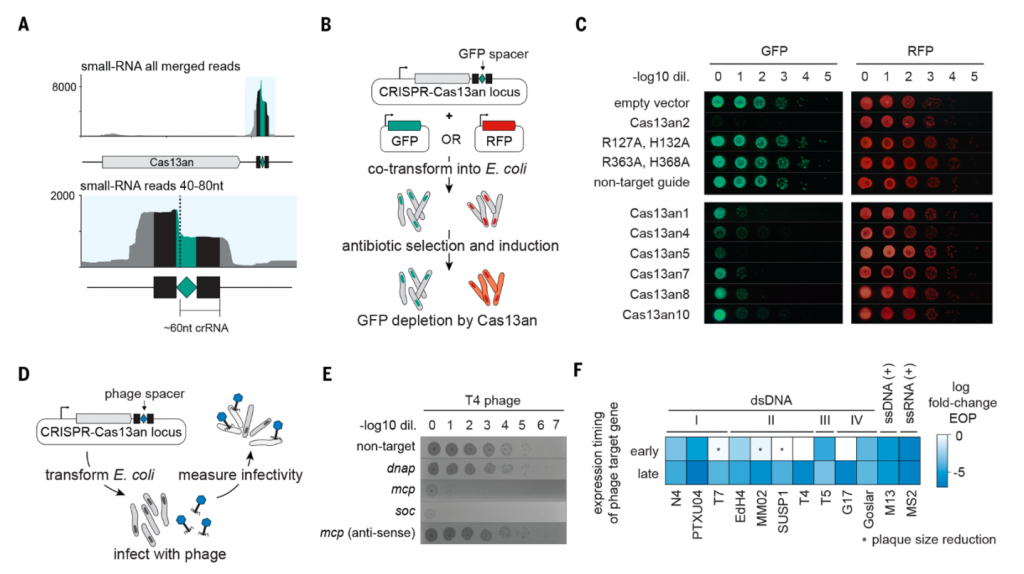
该研究表明,与较大的Cas13不同,Cas13an用于crRNA加工和RNA引导的切割的是一个单一的活性位点,揭示了祖先核糖核酸酶(ribonuclease)结构域的两种活性模式。
论文通讯作者 Jennifer Doudna 教授表示,在从细菌到人类的许多生物体中,40%-80%的基因编码了功能未知的蛋白质。这项新研究展示了如何通过对由AlphaFold等人工智能生成的结构数据库进行比较分析来发现新的蛋白质功能。这项研究研究回答了有关CRISPR进化的基本问题,并发现了新的基因组编辑工具。除了这些发现之外,该研究开发的策略还可以轻松应用于其他令人兴奋的生物学问题。
总的来说,Cas13an的发现加深了我们对CRISPR-Cas进化的理解,并为精确的RNA编辑提供了更多机会,展示了结构引导的基因组挖掘的前景。
CRISPR/Cas9系统作为当前最热门的基因编辑工具之一,在临床上具有广阔的应用。结合AAV载体,这一技术展现出实现精准基因矫正和治疗的巨大潜力。派真CRO一站式服务平台,可提供从基因合成、载体构建到病毒包装的整体解决方案,全面支持您的基因编辑研究。我们还提供多种CRISPR现货AAV产品。
