mRNA技术及其递送系统的进步,使得基于mRNA的治疗手段进入了医学的新时代。mRNA编码的蛋白具有快速、有效和短暂的特性,无需进入细胞核,不存在基因组整合的风险,使其成为治疗一系列疾病的理想工具。mRNA易于快速生产和大规模制造,成功地支撑了全球对COVID-19大流行的快速响应。然而,mRNA的稳定性、表达持续时间、递送效率和靶向性仍存在诸多挑战。近日,发表在著名医学期刊《柳叶刀》上的一篇综述总结了mRNA技术在疫苗、免疫疗法、蛋白质替代疗法和基因组编辑中的应用进展,以及mRNA递送系统的研发和应用进展。
基于mRNA的疫苗和治疗手段是一项快速发展的技术。自1990年首次在体内验证mRNA以来,mRNA平台技术已经取得了实质性进步。COVID-19大流行期间,mRNA平台展示了其在解决新兴危机方面的成本效益和速度。当前mRNA平台的关键优势包括:有效、快速和短暂的表达,无需进入细胞核,没有基因组整合的风险,设计简单,制备迅速。使得mRNA治疗成为各大药企和生物技术公司争相进入前沿领域。
mRNA药理学基础和mRNA技术的最新进展
合成的mRNA具有非常高的表达量,不需要核内递送,并且可以补充各种类型的蛋白。目前已经开发了多种修饰方法来减少mRNA的免疫原性,增强其稳定性和表达水平。合成的mRNA由五个关键元素组成:5’端帽、5’非翻译区(UTR)、编码序列区域、3’非翻译区(UTR)以及聚腺苷酸(poly[A])尾。对这些基本区域进行优化可以增强mRNA的稳定性、翻译和免疫逃逸能力。

图1 合成的mRNA
5’端帽是mRNA的关键组成部分,对翻译启动和防止核酸酶降解至关重要。使用合成核苷酸共转录加帽是一种常见的技术,用于结合5’端帽并启动翻译。5’UTR和3’UTR的筛选和优化通常是为了提高翻译效率,减少mRNA衰减。BioNTech进行了深入的细胞库筛选,以鉴定稳定而高效的3’UTR候选者,这些候选者被用于BNT162b2 COVID-19疫苗(辉瑞-BioNTech)。除了选择最优的UTR外,还使用了各种密码子优化方法,如去除发夹结构、减少二级结构和改变鸟嘌呤-胞嘧啶含量。为了减少免疫原性和mRNA衰减,已经使用了包括假尿嘧啶(ψ)、N1-甲基假尿嘧啶(m1ψ)、5-甲基胞嘧啶(m5C)、2-硫尿嘧啶(S2U)和5-甲基尿嘧啶(m5U)在内的核苷酸修饰。m1ψ是最常用的修饰核苷酸,用于减少免疫原性和毒性。在BNT162b2和mRNA-1273(Moderna)COVID-19疫苗中使用了将尿嘧啶完全替换为m1ψ的方法。S2U和m5C的组合在蛋白表达方面显示出了有潜力的结果。为了避免mRNA直接激活免疫翻译,CureVac等公司选择使用序列工程而不是使用修饰的核苷酸。带修饰核苷酸的mRNA与序列工程化mRNA的耐受性仍在讨论中。
合成mRNA中的最后一个基本元件是聚腺苷酸(poly[A])尾,这对调节mRNA的稳定性和翻译效率至关重要。聚腺苷酸尾可以通过酶促添加或从DNA模板转录。直接转录poly(A)操作简单,而且可以对poly(A)的长度进行精确控制,因此更为常见,而酶促技术的优势是可提供尾部修饰,从而减少对核酸外切酶的敏感性,增加mRNA半衰期的优势。
在mRNA的纯化方面,高效液相色谱法是一种常用但昂贵且耗时的方法,用于去除RNA污染物,包括可能激活免疫反应的双链(dsRNA)杂质。更简单的基于纤维素的色谱法是HPLC的替代方法,另外也有人使用其它各种基于柱的方法对mRNA进行纯化。
为传染病大流行而储备的mRNA技术
在COVID-19大流行期间,改良的mRNA-LNP疫苗平台得到了成功应用。美国国防高级研究计划局(大流行预防平台)和其他机构正在开发应对新流行病的系统。通过测序从存活患者那里获得的血液样本来识别病原体,克隆B细胞以获得中和抗体,并将最有效的中和单克隆抗体用于mRNA的递送。该方法目前已进入临床试验,且可能成为未来全球用于新流行病或疫情的疗法。
mRNA疫苗
mRNA疫苗的作用原理是通过将编码病原体抗原的合成mRNA转染到抗原呈递细胞中来触发免疫反应。这些特定的抗原被处理、提呈至细胞表面或分泌并被免疫细胞识别,从而引发保护性的体液和细胞毒性T细胞反应。
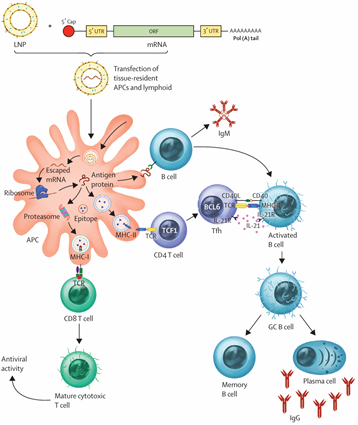
图2 mRNA疫苗诱导的免疫反应
1.针对传染病的疫苗
①.HIV
HIV-1疫苗开发的重点是诱导广泛的2层病毒株中和抗体。HIV-1 mRNA-LNP疫苗在非人灵长类动物中诱导了至少41周的持久中和抗体,目前有多个HIV-1 mRNA-LNP疫苗1期临床试验正在进行中。
值得注意的是,一项临床试验(NCT03547245)研究了一种针对生殖细胞系的靶向免疫原(eOD-GT8 60mer),以刺激针对特定HIV-1病毒包膜蛋白区域的罕见bnAb前体B细胞。该研究使用佐剂AS01B(单磷酸脂A和皂角素),在健康成人中诱导了VRC01类反应,记忆B细胞的中位频率为0.1%。使用修饰的mRNA-LNP编码抗原(NCT05001373)也观察到了类似的结果。这些发现支持开发增强方案以诱导VRC01类bnAbs,并鼓励将这一策略扩展到HIV和其他病原体的其他靶标。
②.结核病
结核病是由结核分枝杆菌引起的传染性细菌性疾病。BioNTech已经启动了两项mRNA结核病候选疫苗的1期临床试验(NCT05547464)。
③.疟疾
疟疾是由寄生虫引起的传染病,疟疾mRNA-LNP候选疫苗在小鼠中显示出强大和持久的免疫原性。BioNTech最近启动了一项PfCSP mRNA-LNP疫苗的临床试验(NCT05581641)。
④.寨卡病毒
寨卡病毒是一种由埃及伊蚊(Stegomyia)传播的黄病毒。针对寨卡病毒的mRNA-LNP疫苗已经在临床前研究中显示了保护效果。Moderna公司的寨卡mRNA-1893疫苗正在进行2期临床试验(NCT04917861)。
⑤.狂犬病病毒
狂犬病由狂犬病病毒引起,是一种几乎100%致死的人畜共患疾病。CV7201(NCT02241135)和CV7202(NCT03713086) mRNA-LNP疫苗在临床试验中显示出良好的安全性和耐受性。
⑥.流感病毒
两项1期临床试验(NCT03076385和NCT03345043)评估了针对禽流感H10N8和H7N9病毒的mRNA疫苗,均在健康成人中诱导产生了强烈的体液免疫反应,并且对于特定疫苗剂量具有良好的耐受性。在2期临床试验(NCT04969276)中,对65岁或以上成年人联合接种高剂量的四价流感疫苗和mRNA-1273疫苗(COVID 19疫苗)耐受性良好
2.癌症疫苗
作为癌症治疗的新干预措施,mRNA疫苗编码肿瘤抗原,包括肿瘤相关抗原(TAAs)和肿瘤特异性抗原(TSAs),或免疫调节分子,或这些的组合,用于诱导和微调抗肿瘤免疫反应。BioNTech和Moderna等公司已经投入资源开发个性化癌症疫苗。BNT111是一种mRNA-脂质复合物候选疫苗,在不可切除的黑色素瘤患者中显示出强烈的抗原特异性免疫反应。BNT122是一种个性化的多新表位mRNA疫苗,包含多达20个患者特异性新表位,目前正在研究用于治疗黑色素瘤(NCT03815058)和结直肠癌(NCT04486378)。此外,前列腺癌(NCT01197625)、急性髓系白血病(NCT00514189)和个性化TAA 组合(NCT01334047、NCT02709616、NCT02808364和NCT02808416)的mRNA-DC疫苗也在进行临床试验。
BNT151(一种核苷修饰的IL-12 mRNA)正在1/2期临床试验(NCT04455620)中,探索作为单药治疗或与其他抗癌药物联合治疗晚期实体瘤患者的临床安全性和有效性。
另一类正在研究的mRNA癌症疫苗编码免疫调节分子,这些分子一旦注射到肿瘤部位,就会创造一个促进T细胞扩增和记忆反应的促炎性微环境。
治疗性mRNA的应用
1.单基因疾病和蛋白质替代
目前有包括Moderna在内的多家公司和研究机构正在开发mRNA疗法,用于治疗多种单基因疾病,如甲基丙二酸血症、急性间歇性卟啉病、法布里病和囊性纤维化等。
2.单克隆抗体和免疫疗法
mRNA编码的单克隆抗体用于预防和治疗病毒感染,临床试验显示了其高效表达和保护能力。mRNA技术也正在被开发用于癌症免疫治疗,形式包括mRNA编码的抗体、抗体类似物、双特异性抗体或嵌合抗原受体(CAR)T细胞疗法等。
3.免疫抑制剂
mRNA治疗手段在抑制性免疫疗法、免疫耐受和过敏等领域可能很有用。已有研究报告了一种非炎症性mRNA疫苗用于治疗实验性自身免疫性脑脊髓炎。Moderna已经开始在1期临床试验(NCT04916431)中评估mRNA-6231(一种编码人血清白蛋白-IL-2融合蛋白的mRNA-LNP)的安全性、耐受性和药代动力学。mRNA-6981是一种编码PD-L1的mRNA-LNP,在髓系细胞上增强PD-L1表面表达可用作对自身反应性淋巴细胞的共抑制信号。
4.基因组编辑器
编码基因组编辑器的mRNA具有较高的编辑效率和较低的脱靶效应,这使得更安全的体内基因组修饰成为可能。一项临床试验对TTR淀粉样变性进行了体内CRISPR-Cas9基因组编辑。用LNP递送Cas9 mRNA和sgRNA,单次给药后,TTR蛋白减少约52%(剂量为0.1 mg/kg),且在治疗后1年内TTR持续低水平,未观察到其它副反应。
用LNP向小鼠和猕猴体内递送编码腺嘌呤碱基编辑器的mRNA和靶向PCSK9的sgRNA,在小鼠中观察到高达67%的碱基编辑,在猕猴中高达34%,这导致小鼠LDL浓度稳定降低了约58%,猕猴LDL浓度降低了约14%。
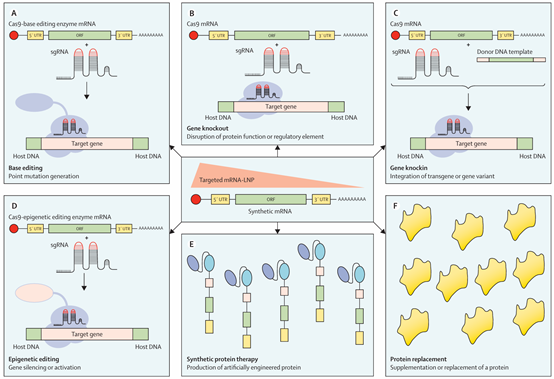
图片3 基于mRNA的治疗方法示意图
肝外mRNA治疗
当通过静脉给药时,LNPs会被动靶向肝细胞和树突细胞,因此,目前静脉注射的LNPs主要用于肝脏治疗应用。但靶向其他组织和器官的mRNA治疗药物具有巨大潜力。如果需要靶向肝外其它组织,可以通过局部给药实现肝外递送。此外,还有一些研究正在尝试开发修饰的LNPs以实现选择性器官靶向。
安全性考虑和潜在挑战
mRNA疫苗的成功展示了其安全性和有效性。然而,治疗性mRNA技术的应用面临更高的安全性要求,还需要克服免疫原性和毒性问题,同时还需要优化表达和递送系统。
结论
mRNA技术已经取得了实质性的进步,尽管面临挑战,但应用前景广阔。相信mRNA技术的进步将继续推动新一代高效、靶向性更好的mRNA治疗平台的发展,为更多疾病带来革命性的干预措施。
主要参考资料:
https://doi.org/10.1016/ S0140-6736(23)02444-3
