杜氏肌营养不良(DMD)是一种致命的遗传疾病,由人类X染色体连锁的DMD基因中的数千种致病突变引起。据估计,每3500-5000名活产男婴中就有1名患有DMD,这也是是最常见的肌肉疾病。
DMD基因编码的抗肌萎缩蛋白参与重要的细胞骨架功能和全身肌肉细胞的存活。致病性DMD突变大多分布在DMD基因的79号外显子中的一些热点区域,导致抗肌萎缩蛋白缺失和肌肉萎缩。点突变和缺失突变都可能产生功能缺失的DMD等位基因。约70%的DMD患者受到外显子缺失突变的影响,导致突变的抗肌萎缩蛋白发生移码表达和功能丧失。然而,目前仍然缺乏有效的、可治愈的DMD干预疗法。
2024年7月15日,福建医科大学第一附属医院李国玲、临港实验室胥春龙、辉大基因杨辉、中国人民解放军总医院第一医学中心吴士文、福建医科大学第一附属医院王柠等人在 Nature 子刊 Nature Communications 上发表了题为:Adenine base editing-mediated exon skipping restores dystrophin in humanized Duchenne mouse model 的研究论文。
该研究使用腺嘌呤碱基编辑器(ABE)介导的外显子跳跃,在人源化杜氏肌营养不良(DMD)小鼠模型中恢复了肌营养不良蛋白表达,通过腺相关病毒(AAV)载体全身系统性递送ABE治疗的DMD小鼠肌肉功能得到了显著改善。

之前的研究表明,通过Cas9或其他核酸酶破坏移码外显子可以恢复功能性抗肌萎缩蛋白的表达。然而,核酸酶诱导的DNA双链断裂(DSB)不仅能够校正DMD等位基因,还会产生很大一部分携带插入或缺失突变(indel)且未经校正的DMD等位基因,此外,Cas9切割DNA后还可能诱导具有有害影响的大型DNA重排。
值得注意的是,以前大多数关于基因编辑治疗的研究并非基于基因人源化的DMD小鼠模型,这阻碍了它们使用人类特异性单向导RNA(sgRNA)来测试治疗效果和脱靶情况。因此,有必要使用高精度且安全的基因编辑工具直接编辑和校正人类DMD基因突变。
近来,腺嘌呤碱基编辑器(ABE)正成为一种颇具吸引力的基因编辑方式,它能够在不造成DNA双链断裂的情况下实现精确的碱基转换,从而纠正基因突变。
为了探究ABE在治疗由外显子缺失突变(占DMD患者的70%)引起的大多数DMD类型中的疗效,研究团队使用人源DMD外显子50替换小鼠DMD外显子50和51.构建了一个基因人源化DMD小鼠模型,模拟DMD缺失突变并可靠地重现人类DMD表型。然后,研究团队使用ABE治疗这些人源化DMD小鼠模型,通过诱导人源DMD外显子50跳跃,成功恢复了全身抗肌萎缩蛋白的表达,强有力地恢复了小鼠心脏、胫骨前肌和膈肌中肌营养不良蛋白的表达。
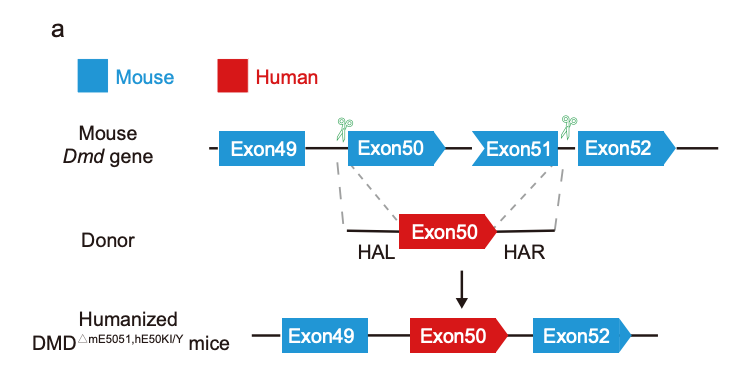
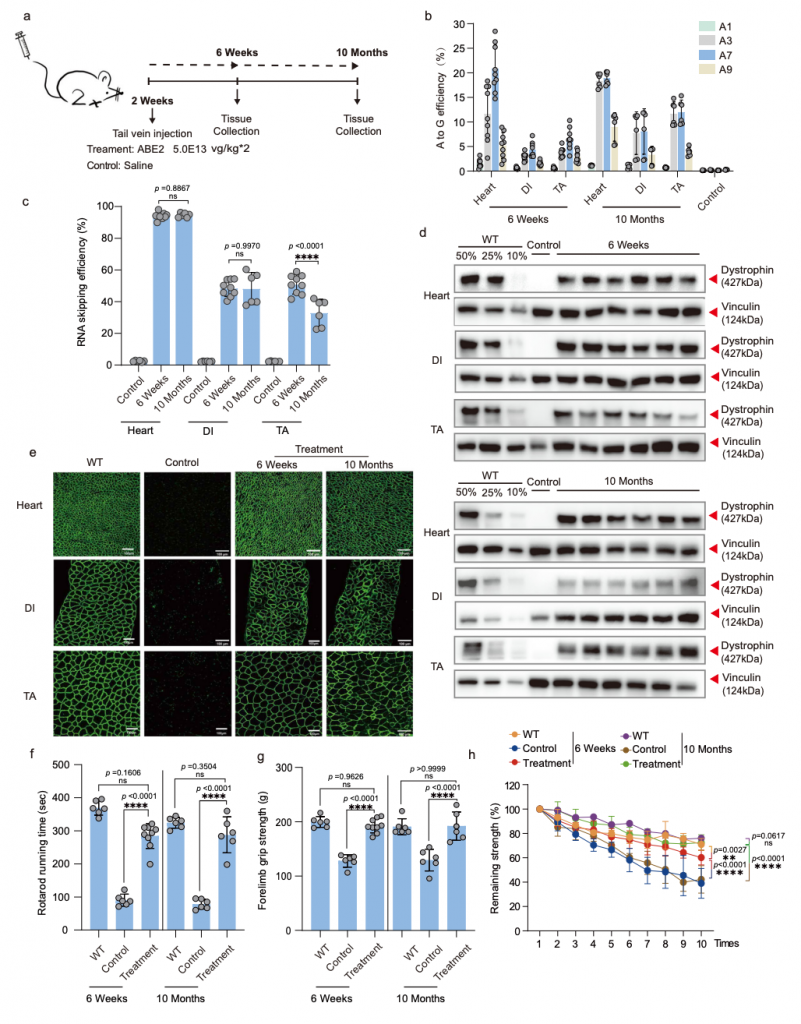
重要的是,通过腺相关病毒(AAV)载体全身系统性递送ABE治疗的DMD小鼠肌肉功能显著改善,将DMD小鼠的肌肉功能改善到与野生型小鼠相似的水平。这表明腺嘌呤碱基编辑器(ABE)在治疗最常见的杜氏肌营养不良(DMD)类型和其他单基因疾病的治疗干预方面具有巨大潜力。
转自:生物世界 https://mp.weixin.qq.com/s/877Ru0hYnGmw30ZX0-rEAw
