但目前的核酸药物递送系统容易在肝脏富集,而包括新冠肺炎、流感、囊性纤维化、原发性纤毛运动障碍、α-1抗胰蛋白酶缺乏症、哮喘,以及肺癌在哪的肺部疾病,亟需一种能够有效将mRNA递送到肺部的载体,以推动mRNA疫苗/疗法对肺部疾病的预防和治疗。
迄今为止,肺部靶向递送mRNA,基本都是使用聚乙烯亚胺(PEI)、脂质纳米颗粒(LNP)在小鼠上进行学术研究,很少在人类中进行的临床试验。其中最出名的临床试验是Translate Bio开发的LNP递送mRNA的雾化制剂治疗囊性纤维化,但遗憾的是,治疗后患者的肺功能并未得到改善。表明了靶向肺部的递送载体还需要进一步改进。
2023年11月20日,麻省理工学院 Daniel Anderson 团队在 Nature Nanotechnology 期刊发表了题为:Combinatorial development of nebulized mRNA delivery formulations for the lungs 的研究论文。
该研究开发了迄今最高效的向肺部递送mRNA的雾化脂质纳米颗粒(LNP)配方,为肺部疾病的基因治疗带来了更有潜力的递送载体。

体内递送mRNA,有望治疗和预防多种遗传病、传染病,以及其他疾病。特别值得注意的是,肌内注射基于脂质纳米颗粒(LNP)的mRNA疫苗对驱动COVID-19大流行的新冠病毒表现出优异的防护疗效。除了用作传染病疫苗外,mRNA技术还被用于肿瘤治疗性疫苗、蛋白质替代疗法和基因编辑中。
基于脂质纳米颗粒(LNP)的雾化mRNA递送的困难与几个雾化和肺特异性障碍有关。
首先,雾化诱导强大的剪切力,会破坏纳米颗粒结构并诱导聚集;
其次,转染支气管上皮需要穿透粘液层,这是扩散的空间和化学障碍;
此外,虽然纳米颗粒摄取在极化肺上皮细胞的基底侧最有效,但基底侧被紧密连接使递送的LNP难以进入;
为了解决雾化挑战,研究团队首先优化了LNP组分比例以提高稳定性,并通过缓冲条件和辅料的理性设计,进一步改善了LNP的稳定性。接下来,研究团队使用体外空气-液体界面(ALI)培养筛选了用于向肺上皮递送mRNA的脂质库。ALI培养被证明具有良好的预测能力,并产生了两个具有优异体内性能的候选脂质——IR-117-17和IR-19-Py。
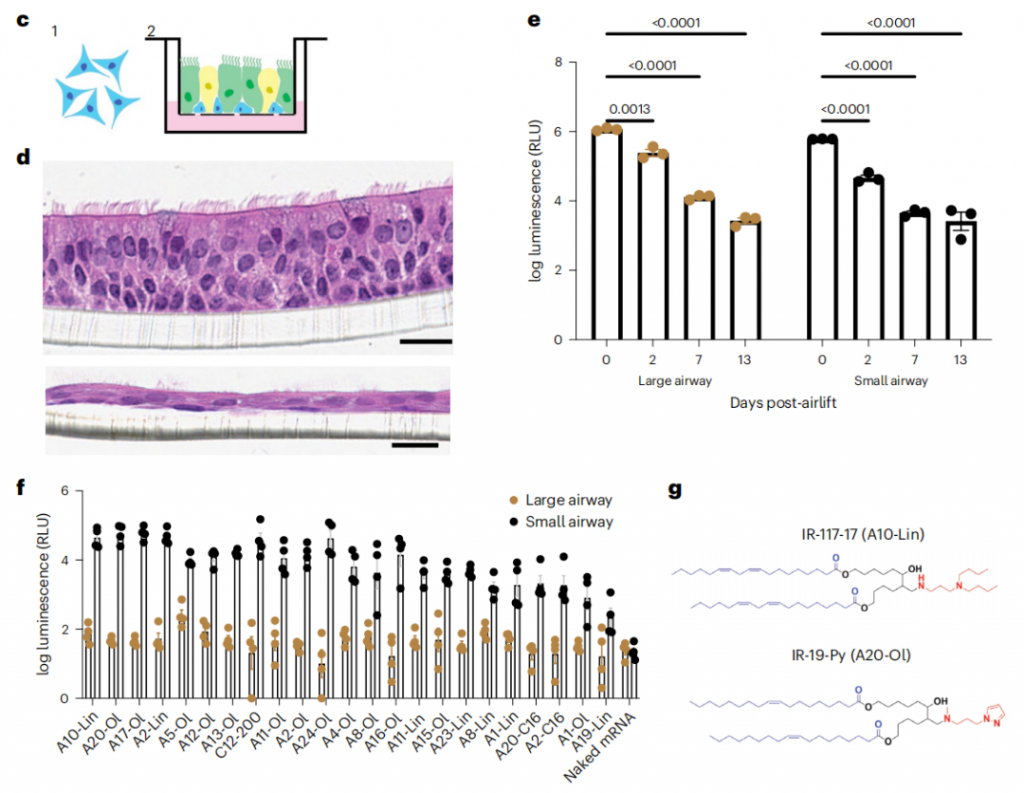
当在优化配方条件下雾化时,这两种脂质分别大大优于最先进的向肺部和鼻腔的mRNA递送载体配方。雾化IR-117-17 LNP在向肺部递送mRNA方面比LNP提高了300倍,比之前报道的超支化聚(β-氨基酯)(PBAE)提高了2倍,包括在向大气道递送方面提高了45倍。
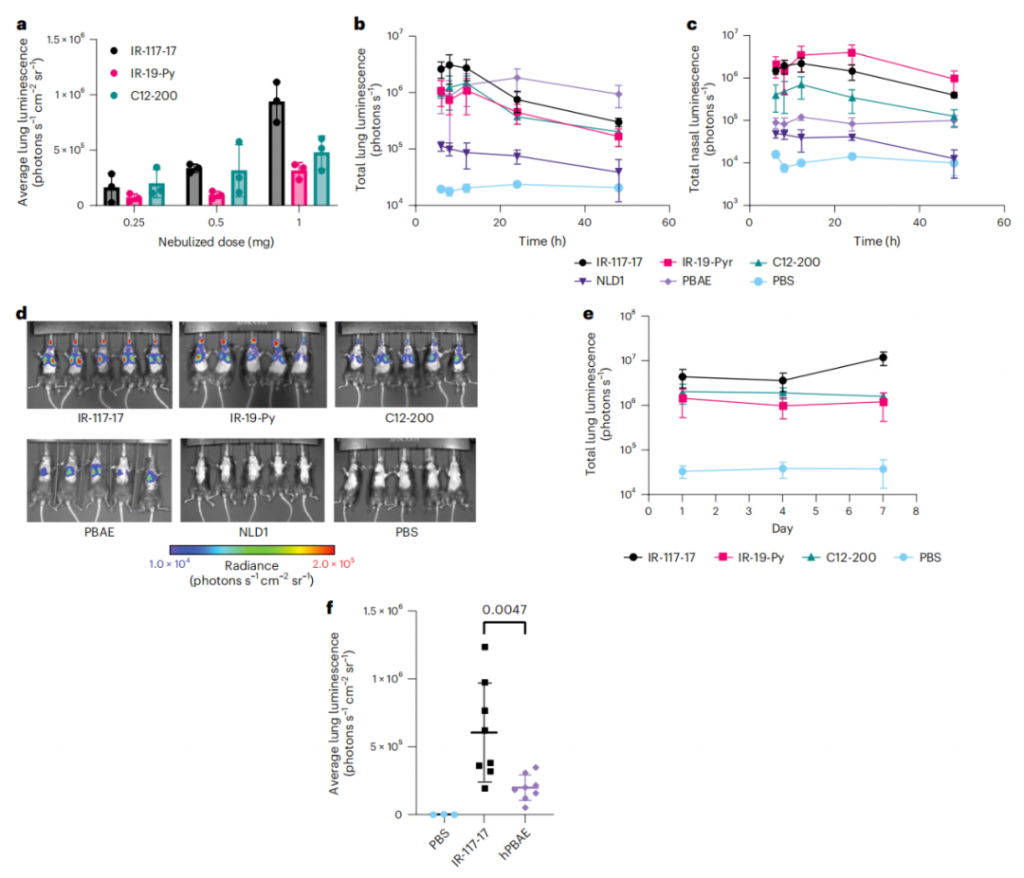
吸入式mRNA具有治疗多种疾病的潜力。然而,雾化脂质纳米颗粒面临着几个独特的挑战,包括雾化时的稳定性和穿透细胞内外屏障。该研究开发了一种组合方法来解决这些障碍。首先,通过改变雾化缓冲液来增加雾化过程中LNP的电荷,并添加支链聚合物辅料,LNP配方可以被稳定,以抵抗雾化诱导的聚集。接下来,研究团队使用还原胺合成了可电离、可降解的脂质组合库,并使用完全分化的空气-液体界面(ALI)培养的原代肺上皮细胞评估其递送潜力。最终开发可电离脂质、电荷稳定配方和稳定性增强辅料的组合,在向肺部递送mRNA的效率方面比目前最先进的LNP和聚合物纳米颗粒有显著改善。
资料来源
1.公众号生物世界
https://mp.weixin.qq.com/s/FDx5E2qHYUKl2Gj3bzl5sA
